港图精华
澳图精华
港贴精华
澳帖精华
百万富翁
[最新] 057期:百万富翁→【独家◇九宫禁肖】←已更新
香港规律
[最新] 057期:赛马会官方→〖正版白小姐杀肖〗
惠泽社群
[最新] 057期:香港惠泽社群《必中一波》
老总来料
[最新] 057期:※总来料※惠泽了知八碼料
外站精料
[最新] 033期:富豪策略□六肖□握机会赚大钱,横财致富千万家
高手解迷
[最新] 【056期】内部来料(长跟必赢发表区)已公开】
平肖平码
[最新] 057期:富豪策略□六肖□握机会赚大钱,横财致富千万家
特码玄机
[最新] 032期:香港总坛12码中特
白姐资料
[最新] 057期:香港总坛12码中特
镇坛之宝
[最新] 057期】镇坛之宝‖≡『禁合今錯一』≡‖免费料
曾道人料
[最新] 057期:曾氏每期野兽与家畜【已公开】
彩图诗句
[最新] 057期:跑狗玄机/密圖詩
本站推荐
[最新] 055期本站推荐料(最新)
赛马会料
[最新] 057期:赛马会提供:《中特码段》
九龙内幕
[最新] 057期本站推荐料(最新)
马会绝杀
[最新] 057期:赛玛荟独家【绝杀一行_与众不同版
246预测
[最新] 057期:香港内部资料【必中生肖】
权威资料
[最新] 057期:王中王解玄机\西游谜语\宝阁特码\一句话赢大钱\生肖幽默
综合正料
[最新] 057期:天机报AB



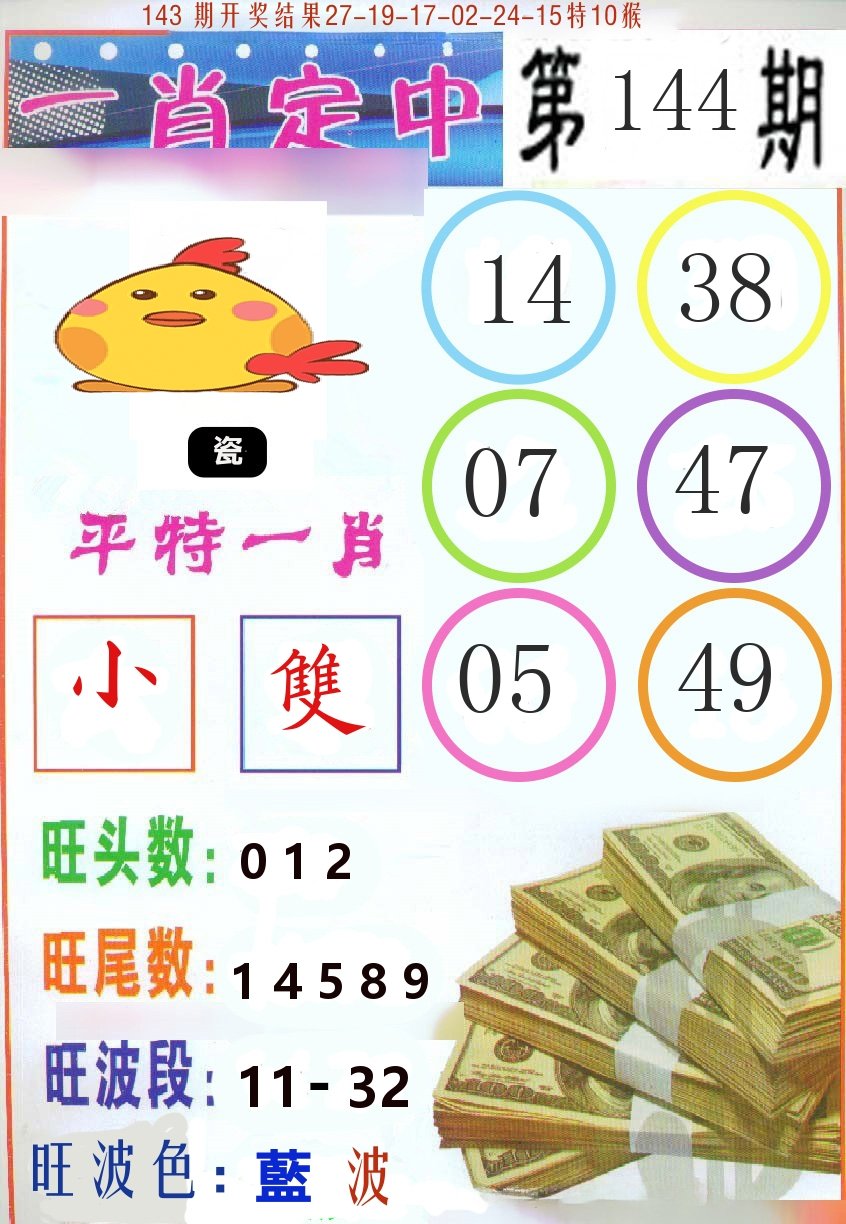
 144期
144期


 澳门天天好彩6肖18码
澳门天天好彩6肖18码